奥村教授(栄養科学研究科)が徳島大学との共同研究で新型コロナや鳥インフルエンザ感染の鍵となるプロテアーゼと阻害剤の複合体構造を決定、「Life Science Alliance」に論文が掲載されました
2021年4月7日
大学院栄養科学研究科の奥村裕司教授と、徳島大学大学院医歯薬学研究部の真板(大野)綾子研究員(現 株式会社キュライオ主任研究員)、二川健教授、先端酵素学研究所の真板宣夫准教授(現 放射線医学総合研究所研究員)らは、共同で新型コロナや鳥インフルエンザのウィルス感染の際に働くプロテアーゼ(MSPL)と阻害剤の結晶構造を初めて報告しました。
この成果は4月5日にLife Science Allianceにオンライン掲載されました。
この成果は4月5日にLife Science Allianceにオンライン掲載されました。
高病原性鳥インフルエンザウイルスや新型コロナウイルスによる感染症の脅威が社会に認知されるに伴い、対策としての予防と治療に向けた研究開発が急務となっています。これらのウイルスがヒトに感染する際には、ウイルスの外膜表面にある糖タンパク質がヒトの気道上に局在するプロテアーゼ(タンパク質分解酵素)によって切断され、感染型に変換することが必要です。これまでの研究で我々は、これらウイルスの活性化酵素として、ヒト気道に高発現し、さらに全身性にも発現が認められる膜結合型酵素(MSPL)を発見し、その酵素学的性状を明らかにしてきました。しかしながら、ウイルス外膜糖たんぱく質の認識機構の解明および特異的な阻害剤の設計には詳細な立体構造解析が欠かせません。MSPLや類似酵素(TMPRSS2)はこれまでその構造が不明のままでした。本研究では、MSPLと阻害剤の複合体の構造を明らかにするとともに、TMPRSS2の構造のモデリングにも成功したことで、これらの酵素を標的分子とした特異的阻害剤を開発することで、高病原性鳥インフルエンザウイルスや新型コロナウイルスによる感染症に対する有効な治療薬・感染予防薬の開発が進むと期待されます。
*今年になってMSPLもTMPRSS2と同程度新型コロナを活性化させるという論文が複数報告されており(1,2)、MSPL阻害剤は新型コロナウイルスの有効な薬剤候補となります。また、信頼度の高いTMPRSS2のモデルを利用して、新たな阻害剤の開発やTMPRSS2のウイルス外膜糖たんぱく質(スパイクタンパク質)との結合予測、さらにACE2との複合体モデルの構築など、新型コロナウイルスに対する新規治療薬の開発がますます加速すると考えられます。
参考文献
1. Kishimoto et al. (2021) Viruses, 13, 384.
2. Hoffmann et al. (2021) EBioMedicine, in press.
1. Kishimoto et al. (2021) Viruses, 13, 384.
2. Hoffmann et al. (2021) EBioMedicine, in press.
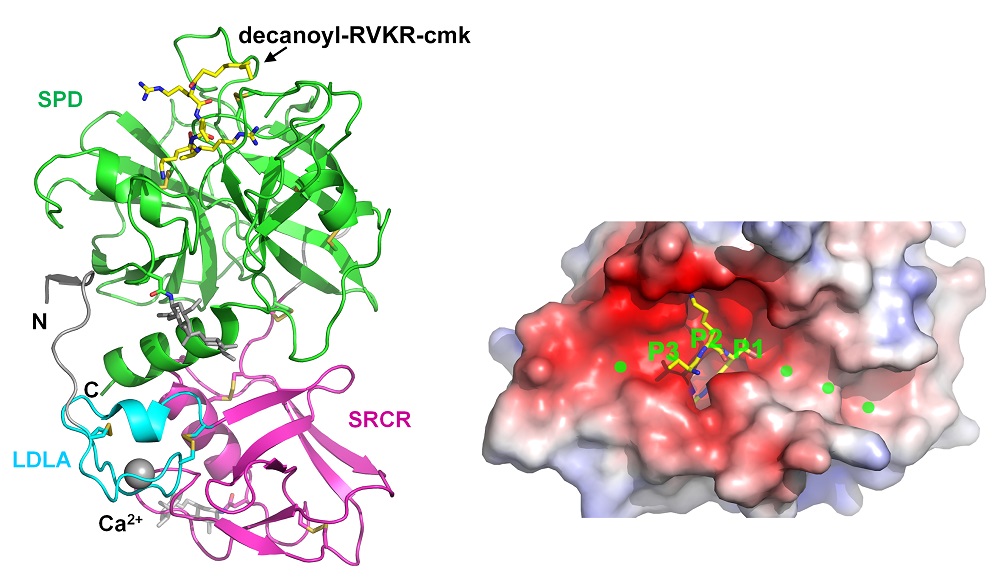
図1 (左)ヒトMSPL細胞外領域の全体構造。3つのドメインをそれぞれ水色(LDLA)、紫(SRCR)、黄緑(SPD:プロテアーゼ領域)で表す。ペプチド様阻害剤(decanoyl-RVKR-cmk)をスティックモデルで表す。(右)ヒトMSPLの活性部位表面電荷図。赤は負電荷、青は正電荷を表す。切断ペプチドのアルギニン(P1)-リジン(P2)-バリン(P3)をスティックモデルで、残りの想定される残基の位置を緑の点で表す。
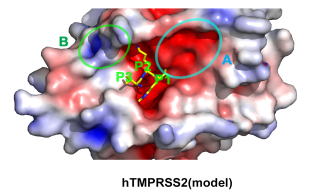
図2 ヒトTMPRSS2の活性部位のモデル構造の表面電荷図。アルギニン(P1)の下流が結合する領域(楕円A)がMSPLよりも広くなっている。